

― 優れた水素吸蔵性能を有する新材料 ―
国立大学法人筑波大学 数理物質系 近藤 剛弘 准教授、国立大学法人 東北大学 材料科学高等研究所 藤田 武志 准教授、国立研究開発法人 物質・材料研究機構 Nguyen Thanh Cuong ICYS-Namiki研究員、同 冨中 悟史 主任研究員、および国立大学法人 東京工業大学 細野 秀雄 教授らの共同研究グループは、二ホウ化マグネシウムと呼ばれる物質を原料に用いた、これまでにない新しいシート状物質(ホウ化水素シート)の生成に成功しました。ホウ化水素シートはボロファンという通称名で既に理論的にその存在が予想されており、新しい水素吸蔵材料や電子材料としての優れた特性が期待されていました。本研究は、この物質の生成を初めて実現したものです。
本研究では、二ホウ化マグネシウムに含まれるマグネシウムの正イオンを水素(H)の正イオン(プロトン)と交換することにより、これまでに無い、水素とホウ素のみで構成される新しい二次元物質が、室温・大気圧下という温和な条件で生成することを見出しました。この物質は負に帯電したホウ素(B)の二次元シート骨格とプロトンとにより構成され、H:B=1:1の組成比であることがわかり、「ホウ化水素シート」と名付けました。
ホウ化水素シートはプロトンを保持しており、200 から1200 ℃の幅広い温度範囲で水素分子を放出するため、理論予測されていた電子材料や水素吸蔵材料以外にも、固体燃料や固体酸触媒としての応用が期待できます。今後、既存材料との組み合わせにより資源・エネルギー・環境に関する様々な問題を解決する新しい材料としての利用が期待されるほか、他の二ホウ化金属や得られたホウ化水素シートをスタート物質として用いることにより、別の新しい二次元物質群の生成も期待されます。
本研究の成果は、2017年9月19日付「Journal of the American Chemical Society」でオンライン先行公開されました。
炭素原子一層からなるグラフェンに代表されるような、原子一層から数層の非常に薄い厚さで構成される二次元物質と呼ばれる物質群は、通常の三次元物質に比べて表面積が大きく、機械的柔軟性があり、特異な電子状態を持っている場合が多く、新しい電子材料や触媒材料の候補として期待が高まっています。また、種類の異なる二次元物質を組み合わせると、さらなる新しい性質が発現することが見いだされており[1]、二次元物質は様々な用途に応用できる大きな可能性を持った新しい物質であり、世界中で活発に研究が行われてきました。そんな中、ホウ素と水素のみで構成される二次元物質(ボロファン)について理論的な研究が行われ、グラフェンを凌駕する優れた電子材料特性や水素吸蔵特性を有するという予想が、2011年と2016年に報告されました[2,3]。ホウ素を含む二次元物質としては、2015年に、ホウ素のみで構成される二次元物質(ボロフェン)が、単結晶の銀の表面上への真空蒸着で生成できることが報告されてはいましたが[4,5]、ボロファンの方は理論予測のみにとどまっていました。
本研究グループは、ボロファンを作成するための母材として二ホウ化マグネシウム(MgB2)という材料に着目しました。MgB2は2001年に超伝導であることが見出されて以降[6]、超伝導材料としての研究が盛んに行われています。ホウ素は物質内に於いて屈強なsp2混成軌道と呼ばれる共有結合をした平面構造を構築しています。このホウ素のハニカム構造骨格が負の電荷を帯び、マグネシウムの正のイオンがホウ素骨格間に存在している物質がMgB2です。我々はこのMgB2のマグネシウムの正イオンを水素の正イオン(プロトン)と交換し、層状の3次元構造をバラバラなシート構造にすることで、これまでに誰も実現したことがなかったホウ化水素シートの生成に成功しました。
1. ホウ化水素シートの生成
本研究で行ったホウ化水素シートの生成手順を図1Aに模式的に示します。大気圧の窒素雰囲気中で、MgB2とイオン交換樹脂を室温のメタノールまたはアセトニトリル中で混ぜたのち、沈殿物を取り除いて乾燥させると、平均収率42.3%で黄色い粉末状のホウ化水素シートが得られることがわかりました。この粉末を走査型電子顕微鏡(SEM)で観察すると、しわのあるシート状の構造であることがわかります(図1B)。スタート物質に含まれるマグネシウム(Mg)はイオン交換の過程でイオン交換樹脂に回収されているため、このシート状物質中にMgは存在していません。このことは図1Cに示したX線光電子分光(XPS)注1)の測定結果からわかります。スタート物質であるMgB2(図1C上)とイオン交換後に得られたシート状物質(図1C下)のXPS測定結果を比較すると、イオン交換後にはMgが存在していないため、Mgに由来する光電子ピークが消失しています。また、188 eV付近にあるホウ素(B)の光電子ピークは、Bが負に帯電していることを示すもので、イオン交換後もこのピークが支配的です。すなわち、イオン交換後の粉末試料では正のMgイオンが存在していないにもかかわらず、Bが負に帯電したままになっています。これは、正のMgイオンが、XPSでは観測できないプロトンとイオン交換していることを示唆しています。なお、スタート物質に含まれる193.2 eVの光電子ピークは、MgB2表面に存在している酸化物(不純物)に由来しており、試料調製時に沈殿物となり分離される成分に由来するピークです。さらに、イオン交換後の試料に存在する水素の量を調べるために、真空中で試料を加熱し、この際に放出するガスを分析した結果(昇温脱離測定,TDS)、図1D上に示すように、200℃から1200℃までの幅広い範囲で水素分子が多量に放出されることがわかりました。また、別々に作成した複数の試料に対して、放出される水素分子の総量と、加熱前の試料の重さから試料の組成比をそれぞれ算出したところ、どの試料も、比較的再現性良く、H:Bがおよそ1:1であることがわかりました(図1D下)。以上の結果から、MgB2 + 2H+ → Mg2+ + 2HB という反応式で示されるイオン交換反応により、H:Bが1:1の組成比であるホウ化水素シートが形成することが明らかとなりました。
興味深いことに、1923年~1924年および1959年に発表された研究成果に、本研究と類似の物質が生成されていることを示す記述があります[7,8]。水素とホウ素で構成されるガスが特定の条件下で、水素とホウ素の組成比がおよそ1:1の黄色い固体物質になることが報告されていますが、水素の放出温度が200℃よりも低く、また後述する水素の結合状態が本研究とは異なるため、これらはホウ化水素シートとは別の物質であると考えられます。
2. ホウ化水素シートの構造
ホウ化水素シートの構造をより詳細に調べるために、透過型電子顕微鏡(TEM)で観察しました(図2A)。シート断面のプロファイル(図2B)からシートの厚さが高々数原子層程度であることがわかりました。また、TEM観察中に電子エネルギー損失分光(EELS)という測定を行った結果(図2C)、シートを構成しているBに由来するピークが190-200 eV付近に2つに分かれて鋭く現れており、炭素(C)や窒素(N)や酸素(O)に由来するピークは現れていないことから、このシートが確かにBで構成されていることがわかりました。Bの2つのピークはπ*とσ*と呼ばれるピークであり、これらの存在は、ホウ化水素シート中のBが、sp2混成軌道と呼ばれる平面構造を構成する共有結合性の軌道で結合していることを意味します。これは図1Aに示したMgB2中のBのハニカム構造の平面状の骨格構造が、イオン交換後のホウ化水素シートにおいても保たれて存在していることを示しています。
また、ホウ化水素シートに対して電子線回折を行うと、規則構造に起因するような回折スポットは観測されず(図2B)、またX線回折では幅の広いピークだけが観測されました(図3B)。これらの結果はホウ化水素シートの構造に長距離秩序が無いことを示唆しています。しかしながら、ホウ素と水素のように軽い原子で構成される物質の場合、電子線回折を測定する際の電子線の照射で試料の構造が壊れて、本来存在するはずの長距離秩序構造が観測できていない可能性があるほか、グラフェンシートのような柔軟性のある二次元結晶の場合にはX線回折でピークが現れない事例が知られていることなどから、これらの結果だけでは、長距離秩序が無いと結論づけることはできません。そこで、1ナノメートルほどの電子線スポットにおいて0.1ピコアンペア程度の低強度の電子ビームを用い、微小領域の電子線回折の観察を試みました。この結果、わずかではありますが、局所的な結晶構造の回折に由来する信号が観察されました(図3A右上)。これは試料全体で取得した電子線回折像(図3A右下)では見られない信号であり、本研究で得られたホウ化水素シートは本質的に、局所的には短距離秩序を持つが、長距離秩序は持たない構造であることがわかりました。
3. ホウ化水素シートの局所構造
次に、ホウ化水素シートはどのような局所構造で構成された短距離秩序を有しているのかを明らかにするために、X線回折結果(図3B)をフーリエ変換して得られるX線二体分布関数(XPDF)の解析を行いました。実験的に得られたXPDF(図3C)と、モデル局所構造でシミュレートしたXPDF(図3D)を比較すると、両者はよく一致しており、ホウ化水素シートの局所構造が図3Dのような構造であることが示されました。なお、理論予測で報告されている他の構造[3]や、様々な種類のホウ素と水素のガス(ボラン)やサイズの小さい既存の水素化ホウ素分子構造でも比較を行いましたが、いずれも実験結果を再現できず、図3Dの構造のみが、良い一致を示しました。図3Dの構造はスタート物質のMgB2に含まれるハニカム構造のホウ素の骨格が残っており、イオン交換の観点で対応が取れており、また図2CのEELSが示しているBの平面構造の存在と対応しています。また、この構造に存在するB-H-B結合部分の伸縮振動が、フーリエ赤外吸収分光(FTIR)で1619㎝-1に観測されており、密度汎関数法(DFT)注2)により計算したこの構造におけるB-H-Bの振動吸収ピーク(図4C)1613㎝-1と良い一致を示しています。さらに紫外・可視吸収スペクトルで見られた2.9 eVの光吸収やXPSで得られた結合エネルギーも、この構造に対するDFT計算の値と一致します。図3Dのモデル構造から予想される電子線回折スポットが図3Aの右上で観測された回折スポット位置と一致することも分かりました。以上の結果から、本研究で得られたホウ化水素シートは局所構造として図3Dに示すような構造を有していることがわかりました。
長距離秩序が無く、短距離秩序のみがある理由は、イオン交換反応が起こる際のイオン交換サイトのランダム性で説明できます。図3Dでは、Hの位置は規則正しく特定のBとBの間を橋掛けるように位置して結合していますが、実際にイオン交換が起こる際はMgB2の端や表面から一斉に反応が進行していると考えられるため、特定の方向のBとBの間にだけHが結合するのではなく、様々なB-B間に全体の電荷バランスが保たれるように結合します。いったんB-H-B結合が形成されると、そこの部分のB-B間距離が変化するので、Hの結合位置が不規則であれば試料には長距離秩序が無い状態となります。このため、本研究で得られたホウ化水素シートはBの骨格構造が保たれており、局所構造を有しながらも全体としては長距離秩序がない、特異な構造をしていると考えられます。
本研究で生成したホウ化水素シートはプロトンを保持しており、200 ℃から1200 ℃の幅広い温度範囲で水素分子を放出するため、理論予測されていた電子材料や水素吸蔵材料としての応用以外にも、固体燃料や固体酸触媒として応用できる可能性があります。今後、既存材料との組み合わせにより資源・エネルギー・環境に関する様々な問題を解決する新しい材料として有望であるほか、他の二ホウ化金属や得られたホウ化水素シートをスタート物質として用いて別のイオン交換を行うことにより、別の新しい二次元物質群の生成も期待されます。
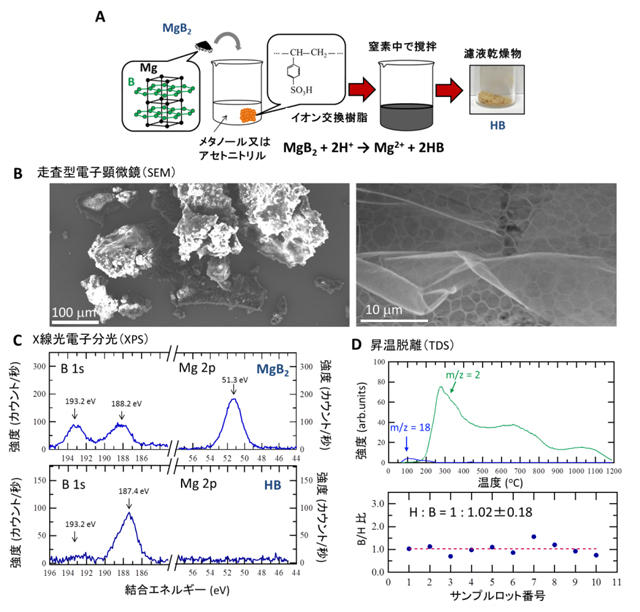
図1 ホウ化水素(HB)シートに関する(A)生成方法の模式図、(B)走査型電子顕微鏡像、(C)X線光電子分光スペクトル、(D)昇温脱離測定結果と算出したB/H比
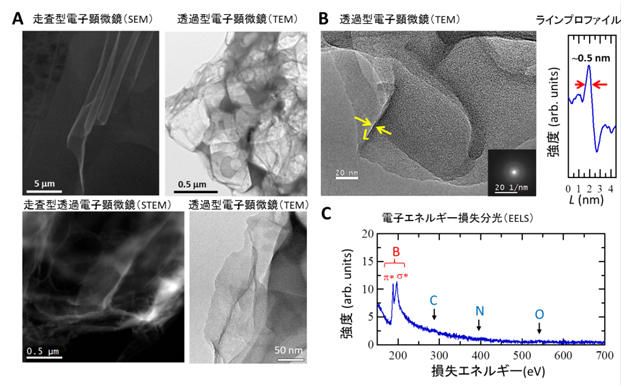
図2 ホウ化水素(HB)シートの(A)走査型電子顕微鏡像、透過型電子顕微鏡像、および走査型透過電子顕微鏡像、(B)透過電子顕微鏡像とラインプロファイル、(C)電子エネルギー損失分光スペクトル
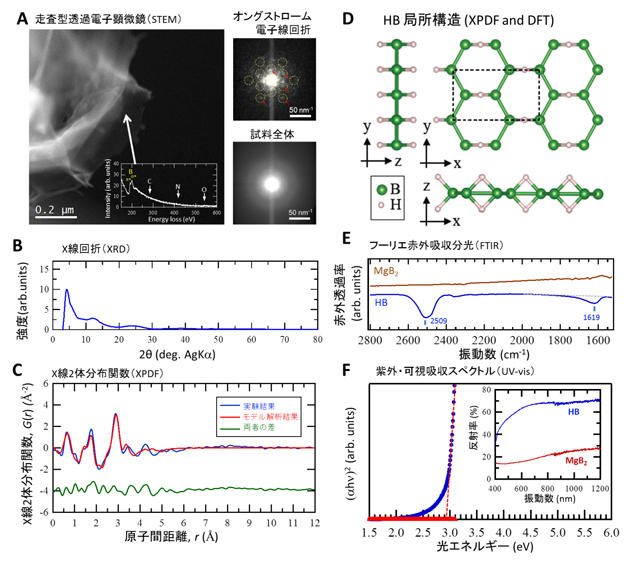
図3 ホウ化水素(HB)シートの(A)走査型透過電子顕微鏡像、電子線回折像、(B)X線回折、(C)X線2体分布関数、(D)局所構造モデル、(E)フーリエ赤外吸収分光スペクトル、(F)紫外・可視吸収スペクトル
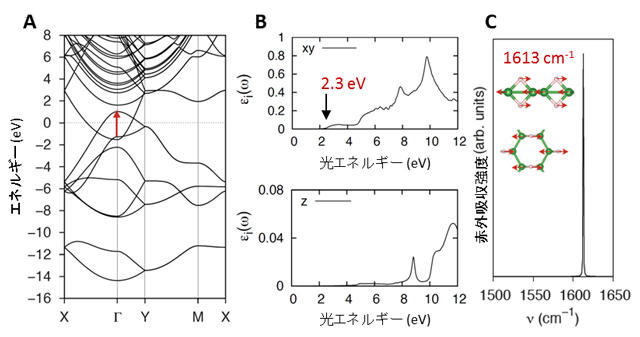
図4 密度汎関数法で計算した図3Dで示すホウ化水素シートモデル構造の(A)バンド図、(B)光吸収スペクトル、(C)赤外吸収スペクトル
DOI: 10.1021/jacs.7b06153
近藤 剛弘(コンドウ タカヒロ)
筑波大学 数理物質系 准教授
| TEL : | 029-853-5934 |
|---|---|
| E-MAIL : | takahiro@ims.tsukuba.ac.jp |