

-ハイドライド・ギャップの克服へ-
東北大学金属材料研究所の高木成幸助教と同大学原子分子材料科学高等研究機構(AIMR)の折茂慎一教授らの研究グループは、水素と結合しにくいと考えられてきたクロムに7つの水素が結合した水素化物の合成に成功しました。これは、日本原子力研究開発機構、高エネルギー加速器研究機構、豊田中央研究所との共同研究による成果です。
金属元素の中には、単独では水素と結合しにくい元素群(=ハイドライド・ギャップ)が存在します。一方、これらの元素は錯体水素化物※2を形成することで多くの水素と結合することができます。唯一の例外がめっきやステンレス鋼などに用いられるクロムであり、単独でも、また錯体水素化物においても、何れも水素とは結合しないと考えられてきました。
今回研究グループは、水素が特定の対称性をもってクロムの周りに配置するとき、一般的な 金属元素よりも多くの水素が結合した錯体水素化物が形成されることを理論的に予測しました。また理論予測に基づき、クロムを含む新たな水素化物の合成に成功し、中性子線※3と赤外線※4を利用して実際にクロムと7つの水素が結合していることを確認しました。この成果は、長年の 課題であったハイドライド・ギャップを克服することにも繋がりました。
水素を高密度に含む水素化物は、水素貯蔵材料※5に加えて超伝導材料※6としての応用が期待されるなど、近年多くの注目を集めています。今回の研究成果は、水素を高密度に含む 水素化物の探索に向けて新たな指針を提示する重要な成果として、ドイツ科学雑誌「Angewandte Chemie International Edition」に受理され、平成27年(2015年)3月13日(現地 時間)にオンライン掲載されました。
水素は最もシンプルな元素であるにもかかわらず、ほとんどの元素と結合して多様な水素化物を形成します。例えば、リチウムイオン電池において電気伝導を担っている リチウム(Li)は、水素(H)と結合してリチウム水素化物(LiH)を形成します。また、半導体素子に用いられるシリコン(Si)には原子1つあたり4つの水素が結合してシラン(SiH4)分子を形成します。これら水素化物の中でも水素を高密度に含む材料は、水素貯蔵材料としての応用のみならず、高圧下において室温近傍で超伝導を示すことが期待されるなど、近年多くの注目を集めています。
多くの元素と非常によく結合する水素ですが、周期表の左から6番目の列から12番目の列に属する元素群はハイドライド・ギャップと呼ばれ、常温常圧にて単独では安定な2元系水素化物※7を形成しないことが古くから知られています。一方で、これらの元素群は錯体水素化物を形成することで多くの水素と結合することができます。一例を挙げると、私たちの生活に最も馴染みのある鉄(Fe)は、錯体水素化物において6つの水素と結合してFeH6イオンを形成します。同じく乾電池に用いられるマンガン(Mn)にも6つの水素が結合してMnH6イオンを形成します。図1に示すように、遷移金属※8原子1つあたりに結合できる水素原子の数は、遷移金属原子の原子番号が小さくなる程多くなる性質があり、鉄やマンガンよりも原子番号の小さいクロムには、さらに多くの水素が結合すると期待されます。その一方で、これまでクロム(とその同族元素※9)は金属元素の中で唯一、単独でも錯体水素化物においても水素と結合しない元素と考えられてきました。
第一原理計算※10を用い、まずはクロムと水素が結合する可能性を詳しく調べました。その結果、図2の右図のようにクロムの周りに7つの水素が双五角錐状※11に配置した とき、クロムと水素が強く結合することが分かりました。また、これにより形成 されるCrH7イオンともう1つの水素原子が3つのマグネシウム(Mg)原子から電子を受け取ることで、図2の左図に示す結晶構造の錯体水素化物Mg3CrH8を形成することが 分かりました。クロムとマグネシウム、水素によって構成される最も一般的な化合物の組み合わせは、金属クロム(Cr)とマグネシウム水素化物(MgH2)、水素ガス(H2)の混合物であり、予測されたMg3CrH8がこの混合物よりも安定であれば合成の可能性を示すことができます。本研究ではマグネシウム水素化物、金属クロム、水素ガスの混合物(3MgH2+Cr+H2)およびMg3CrH8の安定性を第一原理計算により評価し、錯体水素化物Mg3CrH8の合成が可能であるとの結論に達しました。
以上の理論予測を受け、金属クロムとマグネシウム水素化物との混合粉末(Cr+3MgH2)を5万気圧700℃の水素流体中にて4時間保持し、予測された錯体水素化物の合成を試みました。そして大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)にある中性子高強度全散乱装置(NOVA)にて試料の中性子回折測定を行いました。図3b)がその中性子回折プロファイルです。図3a)の理論予測された構造からシミュレートしたプロファイルと比較すると、ピーク位置、強度ともに非常によい一致を示すことから、理論予測どおりクロムに7つの水素が結合したCrH7イオンを含む錯体水素化物Mg3CrH8の合成に成功したことが示されました。
本研究により、クロムが他の一般的な金属元素よりも多くの水素と結合することが 実証され、長年の課題であったハイドライド・ギャップが克服されました。理論計算によると、クロムにはさらに多くの水素と結合できる能力が秘められており、7つの水素のみならず、8つ結合したCrH8イオンや、9つ結合したCrH9イオンなどを含む錯体水素化物の合成が大いに期待できます。今後はさらなる水素の高密度化を進め、新たに合成された錯体水素化物の水素貯蔵や超伝導などの物性・機能性の評価研究を 広範に推進していきます。
本研究成果は、東北大学金属材料研究所の飯島祐樹研究員と佐藤豊人助教、青木勝敏上級研究員、同大学原子分子材料科学高等研究機構の池庄司民夫博士、日本原子力研究開発機構の齋藤寛之博士、高エネルギー加速器研究機構の池田一貴特別准教授と大友季哉教授、豊田中央研究所の三輪和利博士との共同研究によるものです。また、本研究の一部は、日本学術振興会科学研究費補助金(若手研究B(26820312、代表:高木成幸)、若手研究B(26820313、代表:佐藤豊人)、基盤研究S(25220911、代表:折茂慎一))、高エネルギー加速器研究機構物質構造科学研究所中性子共同利用S型実験課題(2014S06、代表:大友季哉)の支援を受け、東北大学金属材料研究所計算材料学センターのスーパーコンピューティングシステムを利用して実施されました。
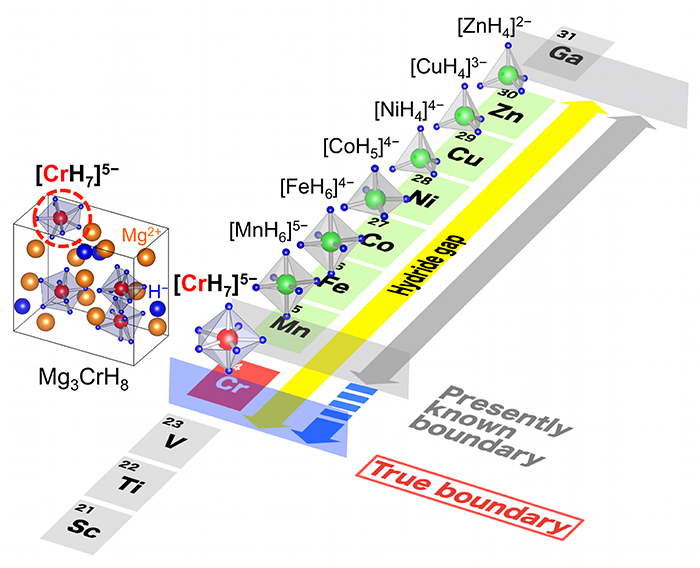 図1:遷移金属が水素と結合して形成する錯イオン群。遷移金属の原子番号が小さくなるにつれて結合する水素の数が増加する性質があります。クロムが水素と結合して 錯イオンを形成するならば、身近な金属では最も多い7つ以上の水素と結合と予測されます。
図1:遷移金属が水素と結合して形成する錯イオン群。遷移金属の原子番号が小さくなるにつれて結合する水素の数が増加する性質があります。クロムが水素と結合して 錯イオンを形成するならば、身近な金属では最も多い7つ以上の水素と結合と予測されます。
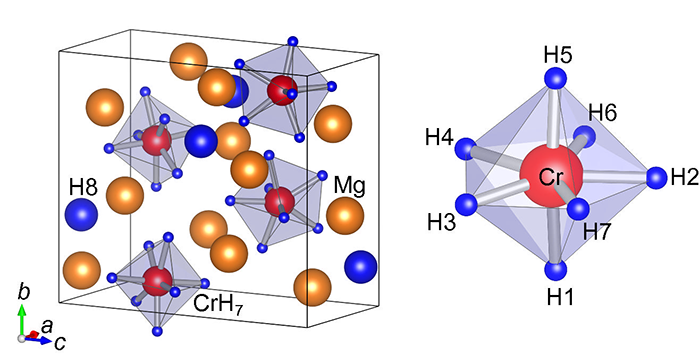 図2:理論予測された[CrH7]5-イオンを含む錯体水素化物Mg3CrH8の結晶構造(左図)とクロムに7つの水素が結合したCrH7イオン(右図)。クロムの周りに7つの水素が双五角錐状で配置したときに、クロムと水素が安定な結合を形成することが分かりました。
図2:理論予測された[CrH7]5-イオンを含む錯体水素化物Mg3CrH8の結晶構造(左図)とクロムに7つの水素が結合したCrH7イオン(右図)。クロムの周りに7つの水素が双五角錐状で配置したときに、クロムと水素が安定な結合を形成することが分かりました。
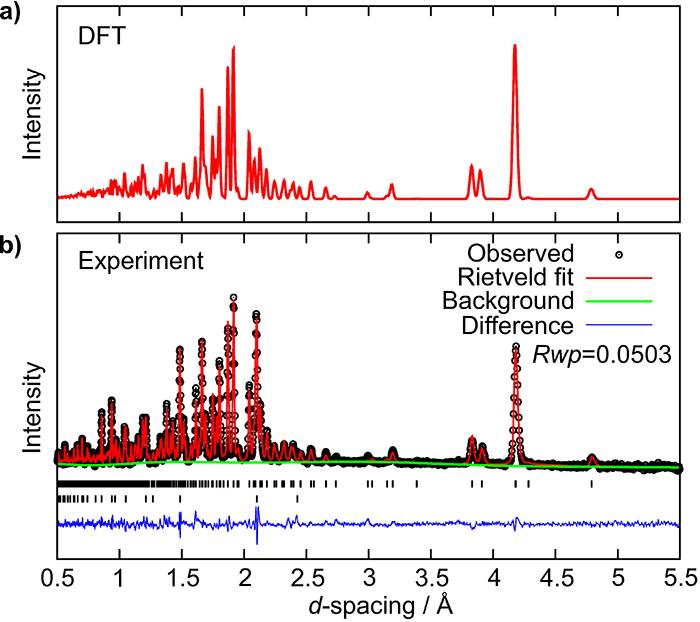 図3:a)理論予測された結晶構造を用いてシミュレートした中性子回折プロファイル、b)大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)にある中性子高強度全散乱装置(NOVA)により得られた中性子回折プロファイル。両者はピーク位置、強度ともによく一致し、理論予測されたMg3CrH8の合成に成功したことが示されました。
図3:a)理論予測された結晶構造を用いてシミュレートした中性子回折プロファイル、b)大強度陽子加速器施設(J-PARC)の物質・生命科学実験施設(MLF)にある中性子高強度全散乱装置(NOVA)により得られた中性子回折プロファイル。両者はピーク位置、強度ともによく一致し、理論予測されたMg3CrH8の合成に成功したことが示されました。
雑誌名: Angewandte Chemie International Edition
タイトル: True Boundary for the Formation of Homoleptic Transition-Metal Hydride Complexes
著者: Shigeyuki Takagi, Yuki Iijima, Toyoto Sato, Hiroyuki Saitoh, Kazutaka Ikeda, Toshiya Otomo, Kazutoshi Miwa, Tamio Ikeshoji, Katsutoshi Aoki, Shin-ichi Orimo
研究内容について
高木成幸(たかぎ しげゆき)
東北大学 金属材料研究所 助教
| TEL/FAX : | 022-215-2094 / 022-215-2091 |
|---|---|
| E-MAIL : | shigeyuki.takagi@imr.tohoku.ac.jp |
折茂慎一(おりも しんいち)
東北大学 原子分子材料科学高等研究機構・金属材料研究所 教授
| TEL/FAX : | 022-215-2093 / 022-215-2091 |
|---|---|
| E-MAIL : | orimo@imr.tohoku.ac.jp |
報道担当
東北大学 金属材料研究所
事務部総務課総務係
| TEL/FAX : | 022-215-2181 / 022-215-2184 |
|---|---|
| E-MAIL : | imr-som@imr.tohoku.ac.jp |
東北大学原子分子材料科学高等研究機構(AIMR)
広報・アウトリーチオフィス
| TEL/FAX : | 022-217-6146 / 022-217-5129 |
|---|---|
| E-MAIL : | outreach@wpi-aimr.tohoku.ac.jp |